Soal dan Pembahasan Kimia SBMPTN 2018 (Kode 420)
Soal dan Pembahasan Kimia UTBK 2018 Kode 420
Bimbel WIN:
Belajar dari bentuk soal yang sudah pernah ditanyakan membuat
persiapan menghadapi ujian yang sebenarnya akan menjadi lebih terarah,
lebih fokus dan lebih efektif.
Bentuk soal yang akan diujikan dari tahun ke tahun pada umumnya
materinya sama. Pada pelajaran yang menitikberatkan pada hafalan soanya bisa
sangat mirip bahkan ada yang persis sama. Sedangkan pada soal hitungan,
rumus dan analisanya pada umunya sama.
Oleh karena itu, kami menyarankan bagiadik-adik calon mahasiswa
baru (camaba) tahun ini, kuasailah minimal 10 tahun terakhir soal ujian yang sudah
pernah keluar.
Pada kesempatan ini, bimbel WIN berbagi soal asli Kimia
SBMPTN tahun
2018 kode 420 lengkap dengan
pembahasannya yang mudah untuk dimengerti. Di akhir pembahasan, kami juga
mengajak adik-adik camaba untuk tetap berlatih pada soal online yang sudah kami
siapkan, Ayouk teruslah berlatih...!!! Semoga tahun ini kalian semuanya yang
belajar disini bisa lolos di pilihan pertama kalian, Amiiin... 🙏🙏
Pembahasan:
Senyawa pada gambar merupakan senyawa alkohol sekunder, senyawa tersebut jika di oksidasi maka akan menghasilkan keton. Rumus molekul pada keton adalah R - C = O
💥 Kunci Jawaban : C
- (A) tetrahedral dan polar
- (B) bipiramida segitiga dan polar
- (C) planar segiempat dan nonpolar
- (D) jungkat-jungkit dan non polar
- (E) piramida segiempat dan nonpolar
Pembahasan:
Diketahui nomor atom unsur S = 16, nomor atom unsur F = 9
Tentukan elektron valensi dari masing-masing unsur dan total elektron valensi dari \(S{F_4}\)
- Unsur \(_{16}S = 1{s^2}2{s^2}2{p^2}3{s^2}3{p^2} \to e.v = 6\)
- Unsur \(_9F = 1{s^2}2{s^2}2{p^2}\,\,\,\,\,\,\, \to e.v = 7\)
\(S{F_4}\) total e.v = e.v S + (e.v F x banyaknya unsur F)
= 6 + (7 x 4)
= 6 + (7 x 4) = 6 + 28
= 34
Tentukan Pasangan Elektron Ikatan (PEI) dan Pasangan Elektron Bebas (PEB)
Jumlah PEI = \(\frac{{total\,e.v}}{8}\)
\( = \frac{{34}}{8}\)
= 4 dan ada sisa 2 e.v
Notes : angka pembagi 8 digunakan untuk memenuhi aturan octet
Jumlah PEB = \(\frac{{sisa\,e.v}}{2}\) \( = \frac{2}{8}\) =1 PEB
Jadi, \(S{F_4}\) memiliki 4 PEI dan 1 PEB
Maka, tipe molekul \(S{F_4}\) adalah \(A{X_4}E\) E dengan bentuk jungkat-jungkit. Kemudian karena terdapat 1 PEB sehingga menyebabkan tarikan elektron menjadi tidak merata atau asimetris. Maka \(S{F_4}\) bersifat polar.
💥 Kunci Jawaban : D
- (A) \(6,7 \times {10^{25}}\)
- (B) \(6,0 \times {10^{23}}\)
- (C) \(0,9 \times {10^{23}}\)
- (D) \(5,4 \times {10^{21}}\)
- (E) \(3,0 \times {10^{21}}\)
Pembahasan:
Dik:
% massa CI = 35,5% (Ar CI = 35,5)
tetapan Avogadro = \(6,02 \times {10^{23}}\)
Dit : jumlah atom Cl?
Jawab :
Massa Cl dalam senyawa organik = 35,5% x 0,9 g
= 0,32 g \(Mol\,C(n) = \frac{{massa\,\,CI}}{{Ar\,\,CI}}\)
\( = \frac{{0,32g}}{{53,5g/mol}}\)
\( = 0,009mol\)
Jumlah atom CI (X) = n C x 6,02 x \({10^{23}}\) atom/mol
= 0,009 g/mol x 60,2 x \({10^{23}}\) atom/mol
= 0,54 x \({10^{23}} \to 54 \times {10^{21}}\)
💥 Kunci Jawaban: C
- (A) 430 g
- (B) 427 g
- (C) 342 g
- (D) 280 g
- (E) 171 g
Pembahasan:
Dik :
massa gas CO = 252 g (MrCO = 28)
Massa Ni = 118 g (Mr Ni = 59 )
Dit : massa gas tetrakarbonilnikel?
Jawaban :
Cari masing-masing mol :
- \(n\,\,Ni = \frac{{massa\,\,NI}}{{Mr\,\,Ni}}\)
\( = \frac{{252g}}{{28g/mol}}\)
\( = 9mol\)
- \(n\,\,CO = \frac{{massa\,\,CO}}{{Mr\,\,CO}}\)
\( = \frac{{118g}}{{59g/mol}}\)
\( = 2mol\)
Kemudian gunakan perhitungan stoikiometri:
\(Ni + 4CO \to NI{(CO)_4}\)
Mula-mula : 2 mol 9 mol -
Bereakasi : 2 mol 2 mol x 4/1 (-) 2 mol 1/1 (+) _______________________________________________
Sisa : - 1 mol 2 mol
Pereaksi pembatasnya adalah Ni, karena Ni lebih dulu habis jika bereaksi
Massa \(Ni{(CO)_4}(m) = nNi{(CO)_4} \times MrNi{(CO)_4}\)
\( = 2mol \times 171g/mol\)
\( = 342g\)
💥 Kunci Jawaban : C
- (A) 16
- (B) 18
- (C) 28
- (D) 32
- (E) 44
Pembahasan:
Dik :
Volume gas \(C{H_4} = \frac{1}{4}\) dari volume gaas X
Massa gas C) = 0,7 g ( Mr = 28 )
Massa gas X = 2,8 g
Mr \(C{H_4} = 16\)
Dit : Mr gas X?
Jawab :
Cari mol (n) gas CO :
\(nCO = \frac{{massaCO}}{{MrCO}}\)
\( = \frac{{0,7g}}{{28g/mol}}\)
\( = 0,025mol\)
Berdasarkan persamaan reaksi setara \(C{O_{(g)}} + 3{H_{2(g)}}\)
💥 Kunci Jawaban : C
- (A) +27 kJ \(mo{l^{ - 1}}\)
- (B) - 27 kJ mol \(mo{l^{ - 1}}\)
- (C) + 54 kJ \(mo{l^{ - 1}}\)
- (D) - 54 kJ \(mo{l^{ - 1}}\)
- (E) +81 kJ \(mo{l^{ - 1}}\)
Pembahasan:
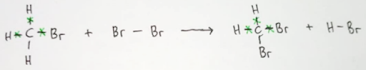
Entalpi reaksi \((\Delta H)\) = total energi pemutusan ikutan (ruas kiri) - total energi pembentukan ikatan (ruas kanan)
Berdasarkan gambar struktur, maka dapat dirumuskan:
\(\Delta H = (\Sigma (C - H) + \Sigma (C - Br) + \Sigma (Br - Br)) - (\Sigma (C - H) + \Sigma (C - Br) + \Sigma (H - Br))\)
\( = (4(C - H) + 1(C - Br) + 1(Br - Br)) - (2(C - H) + 2(C - Br) + 1(H - Br))\)
\( = (410 + 193) - (267 + 363)\)
\( = 603 - 630\)
\( = - 27\)
Maka, \(\Delta H\) nya adalah sebesar \( - 27kJ\,\,mo{l^{ - 1}}\)
💥 Kunci Jawaban: B
- (A) 200
- (B) 100
- (C) 75
- (D) 50
- (E) 25
Pembahasan:
Reaksi disproporsionasi adalah jenis khusus reaksi redoks di mana suatu unsur (reaktan) dari suatu reaksi mengalami oksidasi dan reduksi sekaligus membentuk dua produk yang berbeda.
Ion yang mengalami oksidasi dan reduksi adalah \(MnO_4^{3 - }\) dengan bilangan oksidasi (biloks) Mn adalah +5 sehingga bisa ditulis sebagai \(M{n^{5 + }}\). Ion \(MnO_4^{2 - }\) mempunyai biloks Mn +6, sehingga bisa ditulis sebagai \(M{n^{6 + }}\). Senyawa \(Mn{O_2}\) mempunyai biloks Mn +4 sehingga bisa ditulis sebagai \(M{n^{4 + }}\). Dengan demikian, oksidasi dan reduksi yang terjadi dapat ditulis setengah reaksinya sebagai berikut:
Setengah reaksi:
Oksidasi : \(M{n^{5 + }} \to M{n^{6 + }} + e\)
Reduksi : \(M{n^{5 + }} + e \to M{n^{4 + }}\)
Total : \(2M{n^{5 + }} + e \to M{n^{4 + }} + e\)
Menentukan mol dari manganat (V)
Mol larutan manganat (V) = M x V
= 0,5 M x 200 L
= 100 mmol
Menentukan mol elektron
Mol elektron = \(\frac{{koefisiene\,\,elektron}}{{koefisien\,\,manganat(V)}}\) x mol manganat (V)
\( = \frac{1}{2} \times 100mmol\)
\( = 50mmol\)
💥 Kunci Jawaban: D
- (A) \(N{i^{2 + }}INi\)
- (B) \(P{b^{2 + }}IPb\)
- (C) \(C{u^{2 + }}ICu\)
- (D) \(A{g^ + }IAg\)
- (E) \(A{u^{3 + }}IAu\)
Pembahasan:
Maksud dari soal ini bila sel Volta disusun manakah yang dapat berlangsung spontan (\({E^0}\) sel bernilai positif)
Pada sel Volta, elektrode negatif berarti anode, dan elektrode positif berarti katode. Ingat KP-AN.
Anode (oksidasi): \(2OH_{(aq)}^ - + CI_{(aq)}^ - \to CIO_{(aq)}^ - + 2{H_2}{O_{(l)}} + 2{e^ - }\) dengan \({E^0} = - 0,90V\)
Karena nilai \({E^0}\) oksidasi anode negatif 0,90 V maka di katode harus memiliki \({E^0}\) positif yang lebih besar dari 0,90 sehinggal sel Volta menghasilkan \({E^0}\).
Di antara \({E^0}\) reduksi yang memiliki nilai positif lebih besar dari 0,90 adalah Au. Dengan hasil sebagai berikut.
Sehingga dapat dituliskan dengan \(Au\left. {^{3 + }} \right|Au\)
💥 Kunci Jawaban : E
- (A) 4, 8 x 10\(^{ - 2}{s^{ - 1}}\)
- (B) 3, 6 x 10\(^{ - 2}{s^{ - 1}}\)
- (C) 3, 2 x 10\(^{ - 2}{s^{ - 1}}\)
- (D) 2, 4 x 10\(^{ - 2}{s^{ - 1}}\)
- (E) 1, 6 x 10\(^{ - 2}{s^{ - 1}}\)
Pembahasan:
Persamaan laju - \(\frac{{d\left[ {P{H_3}} \right]}}{{dt}} = k\left[ {P{H_3}} \right]\)
Tanda (-) pada \(\frac{{d\left[ {P{H_3}} \right]}}{{dt}}\) ini menandakan laju pengurangan
\(\left[ {P{H_3}} \right]\) \({d\left[ {P{H_3}} \right]}\) atau laju pembentukan \(\left[ {{H_2}} \right] = \frac{{0,0048mol}}{{2L.\det}} = \) 0,0024 M/detik
\(\frac{1}{4}\frac{{d\left[ {P{H_3}} \right]}}{{dt}} = \frac{1}{6}\frac{{d\left[ {{H_2}} \right]}}{{dt}}\)
\(\frac{{d\left[ {P{H_3}} \right]}}{{dt}} = \frac{4}{6}\frac{{d\left[ {{H_2}} \right]}}{{dt}}\)
\(k\left[ {P{H_3}} \right] = \frac{4}{6}\frac{{d\left[ {{H_2}} \right]}}{{dt}}\)
\(k = \frac{{\frac{1}{4}\frac{{d\left[ {{H_2}} \right]}}{{dt}}}}{{\left[ {P{H_3}} \right]}}\)
\(k = \frac{{\frac{4}{6} \times 0,0024M/dtk}}{{0,1M}}\)
\(k = 0,16{s^{ - 1}} = 1,6 \times {10^{ - 1}}{s^{ - 1}}\)
💥 Kunci Jawaban : E
- (A) 0, 180
- (B) 0, 072
- (C) 0, 030
- (D) 0, 048
- (E) 0, 148
Pembahasan:
Perhitungan stoikiometri:
\(CO2(g) \to C(s) \to 2CO2(g)\)
Mula-mula : 0,8 ~mol -
Bereakasi : 0,3 mol 0,3 mol (-) 0,6 mol _______________________________________________________(+)
kesetimbangan : 0,5 mol ~mol 0,6 mol
\({K_c} = \frac{{{{\left[ {CO} \right]}^2}}}{{\left[ {C{O_2}} \right]}}\)
\({K_c} = \frac{{{{\left( {\frac{{0,6}}{{10}}} \right)}^2}}}{{\left( {\frac{{0,5}}{{10}}} \right)}}\)
\({K_c} = \frac{{0,0036}}{{0,05}}\)
\({K_c} = 0,072\)
💥 Kunci Jawaban: B
- (A) 100
- (B) 250
- (C) 400
- (D) 700
- (E) 1400
Pembahasan:
Dik:
Larutan A: \({m_t} = 4,16g\,BaC{I_2},({M_r} = 208),{m_p} = 2kg\)
Larutan B: \({m_t} = 15\) zat nonelektrolit, \({m_t} = 1kg\)
\(\Delta {T_b}\) larutan \(B = 2\Delta {T_b}\) larutan A
Dit:
Zat nonelektrolit \(({m_{t,}}{m_p},B)\)
Jawab:
Variabel yang ditanya ada pada larutan B sehingga data pendukung bisa dilakukan dengan menelesaikan perhitungan larutan \(A.BaC{I_2}\), diketahui terionisasi sempurna sehingga reaksinya seperti berikut.
\(BaC{I_2} \to B{a^ + } + 2C{I^ - }\)
Terbentuk 3 partikel ion tiap 1 molekul. Oleh karena terionisasi sempurnam faktor van't Hoff akan sama dengan jumlah partikelnya.
\(i = 1 + (n - a)\alpha \)
\( = 1 + (3 - 1)1\)
\( = 1 + 2\)
\( = 3\)
Perubahan titik didihnya dapat dihitung sebagai berikut.
\(\Delta {T_b}(A) = {K_b} \times m \times i\)
\(\Delta {T_b}(A) = {K_b} \times \frac{{{m_t}}}{{{M_r}}} \times \frac{{1000}}{{2000}} \times 3\)
\(\Delta {T_b}(A) = {K_b} \times \frac{1}{5} \times \frac{2}{3}\)
\(\Delta {T_b}(A) = \frac{3}{{100}}{K_b}\)
Selanjutnya bisa dilakukan perhitungan terhadap larutan B. Zat terlarutnya nonelektrolit sehingga faktor van't Hoff dipastikan bernilai 1.
\(i = 1 + (n - a)\alpha \)
\( = 1 + (3 - 1)0\)
\( = 1 + 0\)
\( = 1\)
Perubahan titik didihnya dapat dihitung sebagai berikut.
\(\Delta {T_b}(B) = {K_b} \times m \times i\)
\(2 \times \Delta {T_b}(A) = {K_b} \times \frac{{{m_t}}}{{{M_r}}} \times \frac{{1000}}{{{M_p}}} \times i\)
\( \times \frac{3}{{100}}{K_b} = {K_b} \times \frac{{15}}{{{M_r}}} \times \frac{{1000}}{{1000}} \times 1\) \(\frac{3}{{50}} = \frac{{15}}{{{M_r}}} \times 1\)
\({M_r} = \frac{{50 \times 15}}{3}\)
\({M_r} = 250\)
💥 Kunci Jawaban: B
- (A) 12
- (B) 6 - log 5
- (C) 6 + log 5
- (D) 12 - log 2
- (E) 12 + log 2
Pembahasan:
Campuran antara basa kuat (NaOH) dan asam lemah (HCN) dengan jumlah perbandingan yang sama menghasilkan larutan garam terhidrolisis sebagian dengan jumlah yang sebanding pula.
[Garam] = 0,1 mol : 0,1 L
[Garam] = 1 M
Campuran tersebut membentuk garam terhidrolisis sebagian
\(pH = \frac{1}{2}(14 + p{K_a} + \log \left[ {garam} \right])\)
\(pH = \frac{1}{2}(14 + ( - \log (4 \times {10^{ - 10}}) + \log (1))\)
\(pH = \frac{1}{2}(14 + 10 - \log 4 + 0)\)
\(pH = \frac{1}{2}(24 - \log 4)\)
\(pH = 12 - \frac{1}{2}\log 4\)
\(pH = 12 - \frac{1}{2}\log {2^2}\)
\(pH = 12 - \frac{1}{2} \times \log 2\)
\(pH = 12 - \log 2\)
💥 Kunci Jawaban : D
- (A) \(N{H_4}CI\left( s \right)\,\,dan\,\,NaN{H_2}\left( s \right)\)
- (B) \(NaN{H_2}\left( s \right)\,\,dan\,\,NaCI\left( s \right)\)
- (C) \(NaCI\left( s \right)\,\,dan\,\,N{H_3}\left( s \right)\)
- (D) \(N{H_4}CI\left( s \right)\,\,dan\,\,NaCI\left( s \right)\)
- (E) \(N{H_4}CI\left( s \right)\,\,dan\,\,N{H_3}\left( l \right)\)
Pembahasan:
Menurut teori Bronsted Lowry:
- Asam adalah pemberi/donor proton \(\left( {{H^ + }} \right)\)
- Basa adalah penerima/akseptor proton \(\left( {O{H^ - }} \right)\)
Pasangan asam basa konjugasi cirinya adalah kemiripan rumus kimia dengan selisih jumlah H sebanyak satu atom. Kation yang berasal dari basa kuat dan anion yang berasal dari asam kuat, tidak diperhatikan.
Pasangan asam basa konjugasi selalu berasal dari satu zat pereaksi dan satu zat hasil reaksi.
Lebih mudahnya dituliskan seperti reaksi berikut:
\(N{H_4}CI\) (asam) + \(NaN{H_2}\) (basa)
\( \to \) NaCI (basa konjungsi) + \(2N{H_3}\) (asam konjungai)
Maka, pasangan asam-basa konjugasi pada reaksi di atas adalah \(N{H_4}C{I_{(s)}}\) dan \(N{H_{3(l)}}\)
💥 Kunci Jawaban: E
- (A) 1 - metil sikloheksana
- (B) 1 - etil siklopentana
- (C) 2 - bromo - 2 - pentena
- (D) 2 - hidroksi pentana
- (E) 3 - kloro pentana
- (A) 496, 4.560, dan 6.900
- (B) 578, 1.820, dan 2.750
- (C) 736, 1.450, dan 7.730
- (D) 786, 1.580, dan 3.320
- (E) 1.012, 1.904, dan 2.910
Pembahasan:
Na merupakan unsur yang terletak pada golongan 1A dengan konfigurasi elektron \(1{s^2}2{s^2}2{p^6}3{s^1}(2 - 8 - 1)\). Stabil ketika ia melepaskan elektron pertama (membentuk \(N{a^ + }\)) konfigurasi elektron Na 2-8.
Bila suatu spesi stabil (biasa elektron valensinya 8 seperti pada \(N{a^ + }\)) maka diperlukan energi yang besar untuk melepaskan lagi elektron yang dimiliki. Ini ditandai dengan energi ionisasi yang melonjak sangat besar dari sebelumnya.
Oleh karena itu adanya kenaikan energi ionisasi pada unsur Na, maka jawaban yang tepat adalah 496, 4.560, 6.900
💥 Kunci Jawaban: A











0 Response to "Soal dan Pembahasan Kimia SBMPTN 2018 (Kode 420)"
Post a Comment